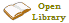PH
 {| align=right style="border: 1px solid #CCCCCC; padding: 1px; margin: 0 0 0.5em 3em; background: #F9F9F9;"
| style="border: 1px solid #CCCCCC; background: #FFFFFF; padding: 1px;" colspan="2" | El pH en fase acuosa en la vida cotidiana:
|-
! Sustancia|| pH aproximado
|-
| Ácido clorhídrico (1 mol/l) ||bgcolor=#990000 style="color:#FFFFFF;"|
{| align=right style="border: 1px solid #CCCCCC; padding: 1px; margin: 0 0 0.5em 3em; background: #F9F9F9;"
| style="border: 1px solid #CCCCCC; background: #FFFFFF; padding: 1px;" colspan="2" | El pH en fase acuosa en la vida cotidiana:
|-
! Sustancia|| pH aproximado
|-
| Ácido clorhídrico (1 mol/l) ||bgcolor=#990000 style="color:#FFFFFF;"|thumb|colores indicadores de pH. El potencial de hidrógeno (pH) es un índice utilizado ampliamente en química y que se suele medir con regularidad en las piscinas de cloro también, que expresa el grado de acidez o alcalinidad de una disolución acuosa. El pH está relacionado con la concentración iones de hidrógeno presentes en determinadas disoluciones. Este término fue acuñado por el bioquímico danés S. P. L. Sørensen (1868-1939), quien lo definió en 1909 como el opuesto del logaritmo en base 10 o el logaritmo negativo de la actividad de los iones de hidrógeno. Entonces sería:
{{ecuación|}} proporcionado por Wikipedia
-
1Número de Clasificación: S III 1323Artículo
-
2
-
3Publicado 1912Otros Autores: “…Stauff, Ph…”
Número de Clasificación: V 0386Libro -
4
-
5Publicado 2006Número de Clasificación: S I 2105Libro
-
6Publicado 1998Número de Clasificación: V 1270Libro
-
7
-
8
-
9
-
10
-
11
-
12
-
13Número de Clasificación: S I 1141Artículo
-
14
-
15
-
16
-
17
-
18Número de Clasificación: S III 1323Artículo
-
19
-
20